عوامل ژنی، نقش روشنی در ایجاد بیماری آلزایمر دارند. نقایص ژنی منفرد (Single Gene) احتمالاً در کمتراز۱٪ از همهی موارد بیماری آلزایمر دخالت دارند. بیشتر موارد بیماری آلزایمر، احتمالاً ناشیاز عوامل خطرزای ژنی و محیطی است. پس پیچیدگی و ناهمگونی ژنتیکی بیماری آلزایمر، ارزش پیشگوییکننده آزمایشهای ژنتیکی را محدود میسازد.
بیماری آلزایمر زود آغاز (Early-Onset Familialal AD) که قبلاز۶۰سالگی رخ میدهد، تقریباً ۵٪ از کل بیماری را تشکیل میدهد. شیوهی انتقال ژنی در بیماری آلزایمر زود آغاز به طور عمده، ۵٪ از کل موارد بیماری را تشکیل میدهد. شیوهی انتقال ژنی در بیماری آلزایمر زود آغاز بهصورت اتوزومال غالب و با اثر تقریبی۱۰۰٪ است. اختلال در سه ژن، بهعنوان عامل بیماری آلزایمر زودهنگام خانوادگی، شناخته شدهاست.
ژن پروتئین پیشتاز آمیلوئید(APP)، Presenilin-1) PS-1) و PS-2 مطرح میباشد. به طور رسمی، اعتبار آزمایشهای ژنتیکی پیشگویی کننده در بیماری آلزایمر زودآغاز، بررسی نشدهاست. هرچند آزمایشهای تشخیصی جذابیت بالایی دارند، اما این آزمایشهای ژنتیکی، موضوعی پیچیده بوده که موارد متعدد شخصی و اجتماعی را دربر میگیرد و باید قبلاز انجام آزمایش، مدنظر قرارگیرند. برای مثال تقریبا در۴۰٪ از خانوادههای بیماران آلزایمر زودآغاز، جهش قابلتشخیصی که منجر به ناهمگونی آللی شده باشد، وجود ندارد. تشخیص یک جهش مثبت، پیامد بدی را برای خانوادهی گستردهی فرد به دنبال دارد که حفظ اسرار پزشکی را الزامی مینماید. انجام آزمایشهای ژنتیکی نباید بهصورت روتین انجام شود، بلکه باید فقط در شرایط رضایت کامل همراه با آگاهی از موضوع، مشاهدهی قبل و بعد از انجام آزمایش و حفظ دقیق اسرار بیمار صورت گیرد.
ژنپروتئین پیشتاز آمیلوئید (APP) که روی کروموزوم۲۱ قراردارد، اولین ژنی بود که ارتباط آن با بیماری آلزایمر خانوادگی شناخته شد. سن شروع بیماری افراد با جهش در APP، در طیف خانوادگی را تشکیل میدهد. بیشتر موارد جهش ژنیAPP، دور یا نزدیک محلهایی درAPP صورت میگیرد که معمولاً بهوسیلهی سکرتازهای آلفا، بتا و گاما قطع میشوند. جهش، موجب تسهیل در تشکیل بتاآمیلوئید ازطریق فعالیت بتا و گاما سکرتاز در APP میشود.
فرض براین است که ژنهای Presenilin، بخشیاز مجموعهی گاماسکرتاز بوده و بهنظر میرسد ایجاد جهشهایی دراین ژنها موجب پیشبرد فرایندی درAPP است که منجر به تشکیل بتا آمیلوئید میگردد. Presenilin-1) PS-1)که روی کروموزوم۱۴ قراردارد، درسال۱۹۹۵ کشف گردید. جهش در PS-1 تقریباً ۳۰٪ تا۴۰٪ از موارد بیماری آلزایمر زودآغاز را تشکیل میدهد. اکثریت قریب به اتفاق موارد جهش در PS-1 شروع بیماری را قبلاز ۵۰سالگی تجربه مینمایند. ژن PS-2 روی کروموزوم شمارهی۱ قرار دارد. میانگین سن برای شروع بیماری آلزایمر در حاملان PS-2، پنجاه و دو سال ذکر شدهاست. بنابراین طیف سنی، کاملاً گسترده بوده و شروع بیماری بین سنین ۴۰تا۸۵ سال در تغییر است.
بیماری آلزایمر دیرآغاز:
بیماری آلزایمر دیرآغاز، شایعترین شکل بیماری را تشکیل میدهد. این نوع بیماری، پیچیدگی بیشتری در مقایسه با انواع زودآغاز دارد و به وضوح عوامل ژنی و محیطی، هر دو در ایجاد آن دخالت دارند. مشکلاتی که در حل موضوع ژنتیک بیماری آلزایمر دیرآغاز وجود دارد به علل زیر است: میزان شیوع AD، با بالا رفتن سن افزایش مییابد، پس بعضی از تجمعهای خانوادگی بیماری، میتواند صرفاً تصادفی باشد. چون بیماری آلزایمر به طور عمده مربوط به سنین بالا است، بسیاری از افراد، قبل از ظهور نشانههای بیماری در آنها، فوت کرده و ارزیابی نحوهی توارث آنها مشکل میشود. در ارتباط با بیماری آلزایمر تعدادی ژن و پیوندهای ژنتیکی (Gene Linkage) گزارش شدهاند. اما فقط APOE عامل خطر ژنتیکی قطعی است.
(Apolipoproteine E (APoEتنها حامل خطرساز ژنی شناخته شده برای بیماری آلزایمر دیرآغاز است که شایعترین شکل بیماری نیز محسوب میگردد. APOE یک پولیمورفیسم ژنی است که بهصورت۳ آلل عمده E2، E3 ,E4 موجود بوده و روی کروموزوم۱۹ قرار دارد. نتایج بررسیهای متعددی ثابت کرده که در حاملان یک آللE4، خطر ابتلا به آلزایمر بهصورت Dose-Dependent است (دو آلل، خطر بالاتری در مقایسه با یک آلل دارد) و با شروع بیماری در سنین پایینتر همراه است. در نقطهی مقابل، وجود یک آللF2،پوشش حمایتی برضد بیماری آلزایمر دارد. احتمالاً APOE، بروزبیماری آلزایمر را ازطریق کنشهای متقابل با بتاآمیلوئید (BA) که موجب افزایش رسوب آمیلوئید در پلاکها میگردد، تعدیل مینماید.
برای تشخیص بیماری آلزایمر، انجام آزمایش ژنتیکی مبنیبر وجود APOE لزومی ندارد و ارزیابی آن بهصورت روتین، منطقی به نظر میرسد. وجود APOE، ارزش پیشگویی درست تشخیص بالینی بیماری آلزایمر رابه میزان کمی افزایش میدهد (از۹۰٪ به ۹۴٪) درحالیکه نبود آن، ارزش پیشبینی نادرست بیماری را افزایش میدهد (از۶۴٪ به ۷۲٪)، تقریباً ۵۰٪ از افراد مبتلا به بیماری آلزایمر، حامل یک یا دو آلل APOE هستند. بنابراین حامل بودن یک آلل APOE بهمعنای آن نیست که فرد به طور حتم مبتلا به آلزایمر خواهد شد و تقریباً ۵۰٪ از حاملان APOE مبتلا به بیماری خواهند شد. آزمایش روتین APOE نقشی در تشخیص جاری بیماری آلزایمر نداشته و فعلاً توصیه نمیشود. خلاصهای از نقایص ژنی در بیماری آلزایمر در (جدول فوق) آمده است.
درمان MCI:
معالجهی پذیرفته شدهای برای اختلال شناختی خفیف(MCI) وجود ندارد. اما مطالعات بالینی متعددی (Clinical Trial) با هدف به تأخیر انداختن سن شروع دمانس، درحال انجام است. نتایج حاصل از مطالعات بالینی کنترلشده Controlled Clinical Trials با استفاده از مهارکنندههای کولیناستراز در پیشآگاهی MCI منفی بوده است (Donpezil & Exelon). درمورد سودمندی داروی Memantin در بیماران با MCI،گزارش تأیید شدهای وجود ندارد. باتوجه به موارد فوق، درمانگران باید از تجویز این دارو در بیماران مبتلا به MCI به امید پیشگیری از پیشرفت آن بهسمت دمانس، خودداری نمایند. اما این امکان وجود دارد که بیماران با Amnestic MCI با توجه به خطر بالای ابتلا به دمانس و افت عملکرد شناختی، بهصورت علامتی از این معالجات، سود ببرند. بهایندلیل که این افراد ممکناست در مراحل آغاز بیماری آلزایمر قرارداشته باشند.
خلاصه:
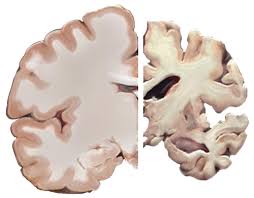
دمانس یکیاز مهمترین و پیچیدهترین مسایل بهداشتی قرن ۲۱ است. تخمین زده میشود که تا سال۲۰۳۰ میلادی، تعداد مبتلایان به دمانس در سراسر جهان، به ۳میلیون تن بالغ گردد. جوامع ما اغلب آمادگی لازم برای مقابله با عواقب مخرب شخصی، اجتماعی و اقتصادی این چنین اپیدمی را ندارند. درمانهای موجود برای بیماری آلزایمر که شایعترین عامل دمانس است، قادر به ایجاد تغییر در سیر بیماری نبوده و مقرونبهصرفهبودن(Cost- Effectiveness) آنها مورد مناقشه است.
هم اکنون گروههای متعددی در سراسر جهان فعالانه درحال پژوهش برای دستیابی به یک معالجهی مؤثر برای بیماری آلزایمر هستند. این تلاشها در راستای ایجاد مداخلاتی با هدف پیشگیری یا به تأخیر انداختن سن شروع نشانههای بالینی بیماری است. این اقدامات، پژوهشی برمبنای دانش نسبی ما از مکانیسمهایی است که در نهایت منجر به بروز بیماری آلزایمر میگرددند که از آن جمله میتوان به واکسن بتاآمیلوئید اشاره نمود.
بتاآمیلوئید پپتیدی است که در پلاکهای پیری دیده میشود و یکیاز عناصر کلیدی اختلالات نوروپاتولوژیک در بیماری آلزایمر است. در مطالعات حیوانی، موشهای واکسینه شده، قادر به پاکسازی بتاآمیلوئید از مغز خود بودند (مثابه آنچه بعداً درمورد انسان مشاهدهشد). اما نتایج واکسن در انسانهای مبتلا به بیماری آلزایمر مأیوسکننده بود و پژوهشگران پساز چندماه و باتوجه به بروز آنسفالیت شدید و مرگ در گروه مطالعاتی، مجبور به قطع مطالعه شدند. از طرف دیگر، در گروه واکسینه شدهای که نجاتیافته بودند، نتایج بالینی مفیدی بهصورت آشکار دیده نشد، که این خود مأیوسکننده است.

این نتایج، فرضیهی اصلی و مرحلهای آمیلوئید در فرایند بیماری آلزایمر را مورد تردید قرارداده و این ایده را مطرح مینماید، که ممکناست بتــاآمیـلوئید (B- Amyloid Peptide) مهمترین علت مشکلات پاتولوژیک در بیماری آلزایمر نباشد. درحالحاضر، نگرشهای دیگری نیز در مورد معالجه و پیشگیری از بیماری آلزایمر وجود دارد که به طور عمده برمبنای یافتههای مطالعات مشاهدهای (Observational Studies) قرار دارند که در آنها ارتباط بین عوامل خطر قلب و عروق و دمانس مورد بررسی قرارگرفته است. ازجمله میتوان به مطالعه گروهRichard Mayeux اشارهکرد. دراین مطالعهی Cohort ۱۱۳۸شخص سالمند سالم ازنظر دمانس، برای یک دورهی متوسط پنج و نیم ساله، مورد بررسی قرارگرفتند. خطر بروز دمانس با حضور چهار عامل خطر شناختهشدهی قلب و عروق یعنی دیابت، فشارخون، بیماریهای قلبی و مصرف سیگار بررسی شد. نتایج این بررسی نشانداد خطر ابتلا به بیماری آلزایمر با بالارفتن تعداد عوامل خطر قلب و عروق، افزایش مییابد. اگر یک ارتباط سببی بین عوامل خطر قلب و عروق و بیماری آلزایمر وجود داشته باشد، بهاینمعناست که ایجاد تغییراتی دراین عوامل باید منجر به کاهش بروز بیماری آلزایمر گردد. در مطالعات متعددی، رابطهی بین معالجهی فشارخون و کاهش میزان بروز دمانس به دنبال استفاده از داروهای ضدفشارخون مورد بررسی قرارگرفت. بررسی نتایج این مطالعات نشان داد، بعید بهنظر میرسد که معالجه با داروهای ضدفشارخون، روش مؤثری برای پیشگیری از افت شناختی و دمانس در سنین بالا باشد.
مدیریت سایر عوامل خطر قلبی ـ عروقی مانند دیابت و چربی بالا تاکنون نتایج ضد و نقیضی در رابطه با پیامدهای شناختی بهرغم تأکید بر وجود روابط امیدوارکنندهی گزارش شده در مطالعات مشاهدهای در برداشته است. همچنین اعتقاد به اینکه استرادیول دارای آثار حفاظتی بر نورونها است (Neuroprotection)، پساز انجام پژوهش (Women Healt Instiative (WHI نهتنها ثابتنشد، بلکه نتایج نگرانکنندهی مطالعه نشان میداد که در زنان معالجه شده با هورمون جانشینشده(HRT)، درمقایسه باگروه شاهد، تقریباً خطر اختلال شناخت و دمانس دو برابر افزایش مییابد. همچنین نتایج محدودی از پژوهشهای شاهد غیرانتخابی بهدستآمده که در آنها از Folate و ویتامینB12 برای کاستن از میزان Homocystein کل پلاسما و با هدف کمکردن خطر بروز دمانس و اختلال شناختی استفاده شدهاست (سطح بالای Homocystein پلاسما با افزایش خطر بروز سکتههای مغزی و بیماری آلزایمر در بررسیهای مشاهدهای همراه بوده است). مدیریت سایر عوامل خطر دمانس مانند فعالیتهای ورزشی یا فکری و استفاده از آنتیاکسیدانها، تاکنون بهصورت جدی به وسیلهی مطالعات کنترلشده تصادفی (Randomized Controlled Trials) موردبررسی قرار نگرفته است. درنتیجه، درحالحاضر این امکان وجود ندارد تا بتوان قطعاً اظهارنظر کرد که آیا انجام این اقدامات، میتواند جانشین عملی برای کاهش خطر بروز دمانس باشد یا خیر. حتی اگر این موضوع صحت داشته باشد، احتمالاً سهم عوامل فوق در کاستن از بروز دمانس کم خواهد بود.
معالجات جاری بیماری آلزایمر، ثمربخشی محدودی داشته و چندان مقرونبهصرفه نیست (تأثیر کم درمقایسه با هزینههای انجامشده (Roor Cost -Effectiveness). مداخلاتی که با هدف پیشگیری از بیماری آلزایمر عوامل شناختهشدهی خطر را مورد هدف قرار دادهاند نتایج مشکوک، منفی و حتی در مورد استروژن و واکسن بتاآمیلوئید، پیامدهای خطرناکی داشتهاند. در حال حاضر به نظر نمیرسد دانش ما در مورد پاتوژنز بیماری آلزایمر برای اتخاذ روشهای موثر در پیشگیری از آن کافی باشد. دانشمندان و سیاستگزاران بهداشتی باید در سالهای آینده با فعالیتی مضاعف برای دستیابی به راه حل قابلپذیرشی برای غلبهبر بحران بزرگی که خیل گستردهی بیماران مبتلا به دمانس برای جوامع بشری بهدنبال خواهند داشت انجام دهند.

ثبت نظر