400-286
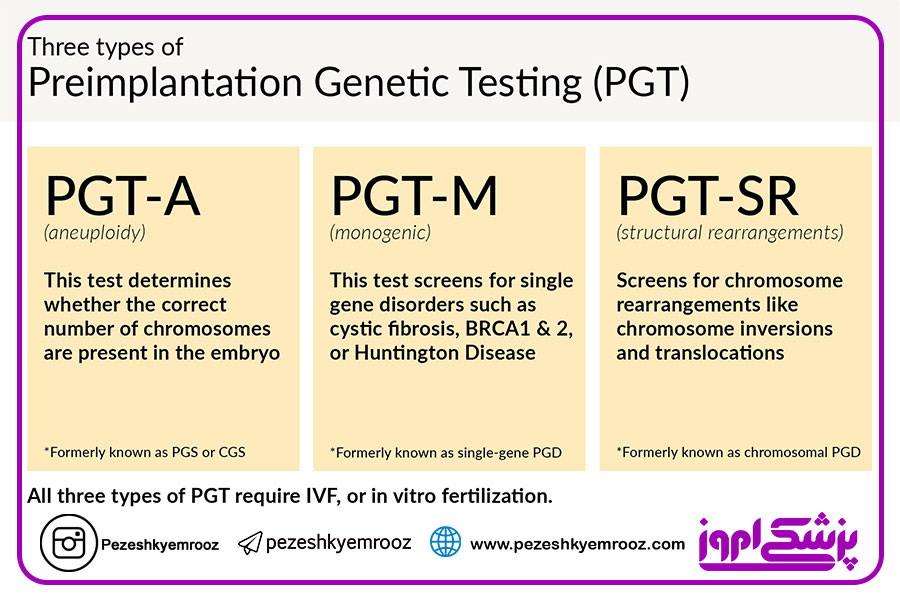
تشخیص ژنتیکی پیش از لانه گزینی جنین (PGT; PGD; PGS)
منبع :شمارۀ ۱۲۴۳ نشریه پزشکی امروز
نخستین و قدیمیترین تاریخ در زمینه تشخیص ژنتیکی پیش از لانه گزینی جنین به سال ۱۹۶۸ که برای اولین بار تعیین جنسیت در بلاستوسیست خرگوش انجام شد، بازمیگردد.
▪ چکیده :
هدف از(Preimplantation Genetic Testing:PGT) پیشگیری از بروز اختلالات ژنتیکی در جنین با کمک لقاح آزمایشگاهی برای انتخاب جنین سالم در مرحله پیش از لانهگزینی است. تاریخ این شاخه از علم ژنتیک با موفقیتهایی که در زمینه تغییر در روشهای کشت جنین و تکنیکهایی که برای تشخیص ژنتیکی ایجاد شده، همراه بوده است. واژههای متداول در این موضوع شامل (Preimplantation Genetic Diagnosis:PGD) یا تشخیص ژنتیکی پیش از لانهگزینی که امروزه آن را بیشتر تحت عنوان تشخیص ژنتیکی پیش از لانهگزینی برای بیماریهای مونوژنیک (PGT-M) میشناسیم. (Preimplantation Genetic Screening:PGS) اصطلاحی است که امروزه جای خود را به PGT-A میدهد و به تشخیص آنیوپلوئیدی پیش از لانه گزینی جنین اشاره دارد. در گذشته PGT-A عمدتا متکی به تکنیک FISH بود اما امروزه روشهای دارای قابلیت بررسی هر ۲۴ کروموزوم از جمله NGS، array CGH، SNP array و qPCR خیلی مرسومتر هستند. بهترین روش برای تعیین اثر بخشی یک روش درمانی، انجام کارآزمایی بالینی تصادفی شده است. تا کنون دو نسل از PGT-A وجود داشته است. نسل اول شامل بیوپسی جنین هشت سلولی در روز سوم حیات آزمایشگاهی یا مرحله کلیواژ است و نسل دوم شامل نمونهبرداری از جنینها در مرحله بلاستوسیست و روشهای بررسی هر ۲۴ کروموزم است. در ادامه به مقایسه این دو نسل خواهیم پرداخت. در اختلالات تک ژنی انجام PGT-M با طرحهای مختلف وراثتی شامل اتوزومال مغلوب/غالب و وابسته به X قابل انجام میباشد. با توجه به شیوع بالاتر برخی از بیماریهای تک ژنی در ایران (بتا تالاسمی) و نیز مورد اقبال بودن ازدواجهای فامیلی و عدم تمایل زنان به استفاده از روشهای تهاجمی تشخیص پیش از تولد و انجام سقط درمانی، استفاده از روش تشخیص پیش از لانه گزینی بهویژه در زوجهای نابارور از جایگاه مهمی برخوردار شده است. در انجام PGT-M بهویژه در روشهای مبتنی بر PCR محدودیتهای مهمی وجود دارد که بایستی همواره مد نظر بوده و سعی در کشف آنها نمود در غیر اینصورت اغلب سبب بروز اشتباهات تشخیصی و در نتیجه تولید جنین مبتلا خواهد شد.
▪ مقدمه :
نخستین و قدیمیترین تاریخ در زمینه تشخیص ژنتیکی پیش از لانه گزینی جنین به سال ۱۹۶۸ که برای اولین بار تعیین جنسیت در بلاستوسیست خرگوش انجام شد، بازمیگردد. در سال ۱۹۷۸ با پا به عرصۀ وجود گذاشتن تکنیک IVF، زمینه برای آنچه ما امروزه بهعنوان PGT میشناسیم فراهم شد. در سال ۱۹۹۰با استفاده از اجسام قطبی برای تشخیص بیماریهای مونوژنیک در مرحله پیش از لانه گزینی جنین، تولد اولین نوزاد حاصل از PGD صورت گرفت. از تکنیک FISH در سال ۱۹۹۳ برای تعیین جنسیت و تشخیص آنیوپلوئیدیها و در سال ۱۹۹۶ برای تشخیص ترانس لوکیشنها استفاده شد. در سال ۱۹۹۹ برای تشخیص بیماریهایی که در سنین بالا بروز پیدا میکنند و در سال ۲۰۰۰ برای HLA Typing استفاده شد. در سال ۲۰۰۹ از تکنیک میکرواری و array CGH استفاده شد و تقریباً آخرین تکنیکی که امروزه پا به عرصۀ تشخیص گذاشته استفاده از next generation sequencing (NGS) در زمینۀ PGT است که در سال ۲۰۱۳ شروع شد.
برای بازسازی اتفاقاتی مشابه با آنچه در داخل بدن در فرایند تشکیل جنین اتفاق میافتد، در محیط آزمایشگاه، لقاح آزمایشگاهی به روش ICSI (تزریق درون سیتوپلاسمی اسپرم) انجام میشود. با انجام این فرآیند، ما روند تکاملی جنین پیش از لانهگزینی را در آزمایشگاه خواهیم داشت و میتوانیم در هرکدام از مراحل تکاملی جنین از اجسام قطبی یا مرحلۀ کلیواژ در روز سوم یا در مرحلۀ بلاستوسیست از سلولهای تروفواکتودرم در روز پنجم یا ششم نمونهبرداری از جنین را داشته باشیم. برای پاسخ به این پرسش که آیا میتوان جنین را بر اساس مورفولوژی قضاوت و انتخاب کرد لازم است بگوییم بررسیهایی که در روز ۳ و ۵ انجام شده، نشان دادهاند جنینهای با کیفیت بسیار مطلوب ممکن است برای یک یا چند کروموزوم آنیوپلوئیدی داشته باشند بنابراین مورفولوژی نمیتواند ملاک انتخاب جنین نرمال از لحاظ کروموزومی باشد.
به لحاظ اندیکاسیون در دنیا بیشترین موارد PGT برای غربالگری آنیوپلوئیدی در جنین صورت میگیرد که چیزی حدود ۶۰ درصد موارد را شامل میشود. در حدود ۱۷درصد موارد با ضرورت تشخیص بیماریهای تکژنی بوده و در ۱۶ درصد موارد بدلیل ناهنجاری کروموزومی و در حدود ۶ درصد با هدف تعیین جنسیت (social sexing or X link disorder) صورت میگیرد. البته آنچه در ایران در حال اتفاق افتادن است شاید ترکیب متفاوتی با موارد ذکرشده داشته باشد و درصد بالایی از موارد را تا به امروز تعیین جنسیت (social sexing) به خود اختصاص میدهد.

▪ موارد استفاده از PGT-A
PGT-A برای تشخیص اختلالات آنیوپلوئیدی برای مادرانی با سن بالاتر از ۳۸ سال برای زوجینی که از سقط مکرر یا از شکستهای مکرر لانه گزینی در فرآیند IVF رنج میبرند، استفاده میشود. در مردانی که مشکلات اسپرمی شدید از لحاظ تعداد و حرکت را تجربه میکنند و همینطور در زوجینی که ممکن است سابقه مشکلات کروموزومی را در بارداریهای قبلی خود اعم از محصول سقط یا تولدهای زنده تجربه کرده باشند، استفاده میشود.
در مرحله پیش از لانهگزینی جنین بسته به نوع تکنیک، بالاترین نرخ آنیوپلوئیدی را در طول تکوین انسان شاهد هستیم. این بررسی بر روی محصولات سقط از کاهش نرخ آنیوپلوئیدی نسبت به مرحله پیش از لانه گزینی اشاره دارد. در موارد مردهزایی این نرخ تقریباً به ۴ درصد میرسد. در تولدهای زنده به ۳ درصد که این اعداد و آمار نشاندهندۀ حذف جنینهای آنوپلوئید است. بیشترین احتمال برای ایجاد آنیوپلوئیدی در مرحله کلیواژ است. در مورد اینکه در هرکدام از مراحل سهگانه بیوپسی شانس تشخیص آنیوپلوئیدی چقدر است میتوانیم بگوییم که اگر فقط جسم قطبی اولیه را بررسی کنیم یا هر دو جسم قطبی را مورد ارزیابی قرار دهیم، تفاوت بسیار زیاد است. در بررسی جسم قطبی اولیه۳۷درصد و در بررسی هر دو جسم قطبی ۷۴درصد احتمال تشخیص آنیوپلوئیدی را برای بیمار خواهیم داشت در حالیکه در مراحل کلیواژ و بلاستوسیست شانس تشخیص آنوپلوئیدی بیش از ۹۰ درصد است.
▪ مرحله انجام بیوپسی جنین و اهمیت آن:
بررسی جنین در هر یک از مراحل تکاملی و نمونهبرداری از آن میتواند مزایا و معایب خود را داشته باشد. مزیت بیوپسی از جنین در مرحله اووسیت این است که مستقیما نمونهبرداری از سلولهای جنین نخواهیم داشت، زمان کوتاهتری جنین در معرض شرایط آزمایشگاهی قرار میگیرد و زمان زیادی برای بررسی داریم. محدودیت بزرگ نمونهبرداری از اجسام قطبی این است که ما تنها اطلاعات مربوط به مادر را خواهیم داشت و هیچ اطلاعاتی در مورد پدر نخواهیم داشت. به نظر میرسد که نمونهبرداری از اجسام قطبی کافی نباشد. بهعنواننمونه اگر آنیوپلوئیدی در اسپرم اتفاق افتاده باشد و یا هدف ما بررسی یک بیماری مونوژنیک هموزیگوت مغلوب باشد، نمیتوانیم جوابی برای بیمار داشته باشیم.
مزیت استفاده از نمونهبرداری در مرحله کلیواژ این است که اگر نیاز باشد میتوانیم بیوپسی مجدد انجام دهیم، نسبت به نمونهبرداری در مرحله بلاستوسیست زمان کوتاهتری در معرض شرایط آزمایشگاهی خواهد بود. محدودیت بزرگ نمونهبرداری در این مرحله آن است که ما نمیتوانیم قضاوتی در مورد موزاییسم جنینی داشته باشیم، چرا که اغلب یک سلول در این مرحله برداشته میشود و ممکن است هنوز سلولهای جنینی همزمانسازی با شرایط رحم نشده باشند و اگر بخواهیم انتقال را در این مرحله انجام دهیم ممکن است میزان موفقیت در کاشت کاهش یابد. نمونهبرداری از سلولهای ترفواکتودرم (TE) در مرحله بلاستوسیست دارای مزیت بزرگی است. سلولهای بیشتری را در اختیار داریم و احتمال بررسی بدون دریافت نتیجه در این مرحله کاهش مییابد. از آنجا که سلولهای TE جدا از توده سلولهای داخلی میباشند، این روش بدون آسیب رساندن به جنین انجام میشود. در این مرحله انتقال تک جنین را میتوانیم راحتتر انجام دهیم. انتقال تک جنین در بسیاری از مراکز پیشرو در زمینۀ IVF به شکل ترجیحی انجام میشود. محدودیت بیوپسی در این مرحله این است که جنین زمان بیشتری در معرض شرایط آزمایشگاهی قرار میگیرد. این موضوع میتواند تأثیرات اپیژنتیکی و سمیتهایی را برای جنین در شرایط کشت به وجود آورد و همینطور ممکن است در بعضی بیماران، بلاستوسیستی نداشته باشیم و شانس کمتری برای رسیدن به مرحله بلاستوسیست را شاهد باشیم.
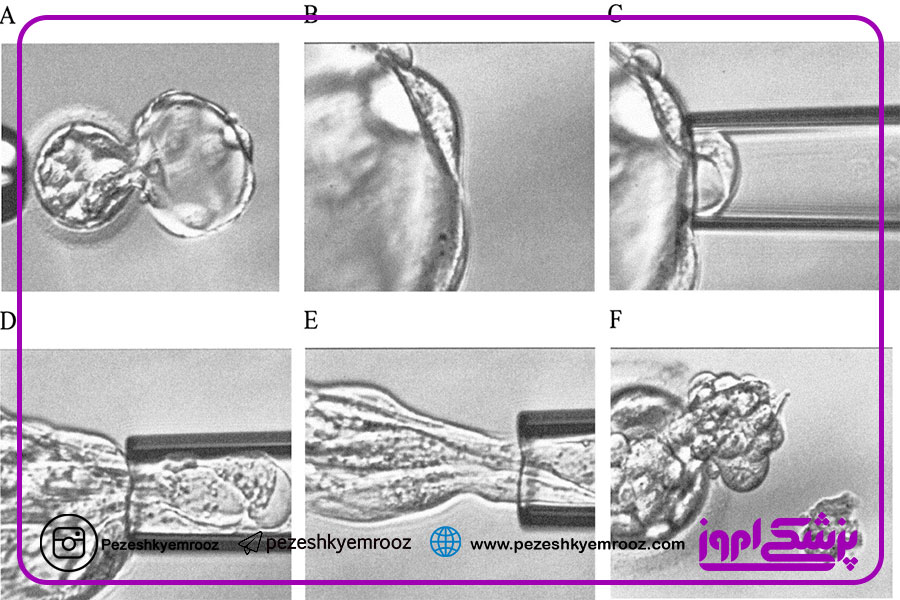
▪ تکنیکهای مورد استفاده برای تشخیص آنیوپلوئیدی در جنین :
آنچه در گذشته بیشتر رایج بوده است و امروزه نیز به ندرت انجام میشود، تکنیک FISH است. این تکنیک تنها تعداد اندکی کروموزوم را بررسی میکند و به همین دلیل مطالعات عمدتاً به سمت استفاده از تکنیکهایی که بتوانند هر ۲۴ کروموزوم را بهصورت همزمان ارزیابی کند، سوق پیدا کردند. یک دسته از این مطالعات میکرواریها هستند که عمدتاً بهصورت تکنیکarray CGH انجام میشود. در این تکنیک DNA جنین با DNA رفرنس هیبرید میشود تا بتوانیم بهصورت مقایسهای بررسی را انجام دهیم .روش دیگر میکرواری استفاده از SNP array است. در این روش رفرنس ما دیتابیسها هستند و نیاز به این نیست که DNA را بهصورت رفرنس و آزمایشگاهی استفاده کرده باشیم.
روش دیگر استفاده از real-time PCR است. در این روش برای هرکدام از بازوهای کروموزوم دو جایگاه بررسی میشود. هر ۲۴ کروموزوم دو بازو دارند و بر روی هر بازو دو جایگاه بررسی میشود. بنابر این ۹۶ واکنش بررسی برای هر جنین انجام میشود. این روش ارزان و سریع است اما انجام آن بهصورت عملی در مراکز IVF به دلیل تعداد بالای جنینهایی که از بیماران مختلف به دست میآید، با چالش مواجه است. نسل جدید توالی یابی یا NGS روش دیگری است که در برخی مراکز استفاده میشود. برای بررسی همزمان آنیوپلوئیدی و یک جهش ژنتیکی بسیار موفق است. بهعنوانمثال ممکن است در بررسی بیماری تالاسمی در یک جنین نتیجه مثبتی برای انتقال گزارش شود، اما اگر جنین دارای آنیوپلوئیدی باشد به مرحله تکامل نهایی نخواهد رسید و حتی در صورت زنده ماندن جنین، مجبور به سقط انتخابی خواهیم شد. این روش گران است و ما اغلب برای نواحی محدودی این بررسی را انجام میدهیم. NGS در تشخیص موزائیسم دقت بالاتری دارد. امروزه استفاده از جنینهای موزاییک در بیمارانی که جنین نرمالی ندارند با در نظر گرفتن این ملاحظه که نوع موزائیسم منجر به تولد بیمار زنده و یا مرگ جنین نشود بهعنوان یک گزینه برای بیماران مطرح است.
از لحاظ مدتزمان میتوان گفت که real-time PCR کوتاهترین زمان را دارد. از لحاظ پیچیدگی SNP array وNGS بیشترین پیچیدگی را دارند. از لحاظ هزینه تجهیزات SNP array و NGS گرانترین هستند. از لحاظ هزینه مواد مصرفی array CGH, SNP array و NGS تقریباً یک قیمت متوسط را دارند و از لحاظ رزولوشن NGS رزولوشن پایین و SNP array رزولوشن بالایی دارد، اما چون تجهیزات و موادِ آن گران است، استفاده از آن در تمامی موارد توجیه اقتصادی ندارد. میتوان گفت که array CGH در تمامی ویژگیها حد متوسط را دارد و این یکی از دلایلی است که از این روش استقبال شده است، هرچند مراکزی که بخواهند بهصورت جدید وارد بحث PGT-A شوند ممکن است NGS را انتخاب نمایند.
چندین پارامتر برای انتخاب روش مناسب از لحاظ بیوپسی و تکنیکهای تشخیص آنیوپلوئیدی شامل امکانات آزمایشگاهی، ماهر بودن کارکنان، انتقال جنین به شکل منجد و تازه، انجام تکنیک در داخل مرکز یا خارج از مرکز دارای اهمیت هستند. بسیاری از مراکز معتقد هستند برای داشتن یک سرویس خوب کمک باروری، PGT-A بهعنوان یک سرویس در کنار تکنیکهای ناباروری دارای اهمیت است.
▪ کارآزماییهای بالینی PGT-A :
به لحاظ پزشکی تنها راه برای تعیین اثر بخش بودن یک روش درمانی،کارآزمایی بالینی تصادفیشده کنترلدار Randomized Controlled clinical Trial (RCT))، ترجیحا توسط چندین گروه و مرکز گوناگون است. اگرچه انجام RCT همواره دشوار است ولیکن کار آزمایی بالینی درمانهای ناباروری بطور اعم و در خصوص روشهای آزمایش ژنتیکی پیش از لانه گزینی بطور خاص بسیار دشوارتر است ، چراکه با عوامل بسیار متعدد و تاثیرگذار روبهرو هستیم. مواردی همچون انطباق و همسان سازی بیماران به لحاظ دلیل ناباروری، سن، شرایط اندومتر هنگام انتقال جنین، کیفیت اسپرم و تخمک، انطباق مورفولوژی جنینها علاوه بر یوپلوئید بودن آنها، دشواری کورسازی تحقیق، تفاوت تجربه آزمایشگاهها در کشت و بیوپسی جنین در تحقیقات چند مرکزی، هزینه بالای تحقیق و عدم تکمیل تعداد از قبل پیش بینی شده بیمار، از اصلی ترین مشکلات در این زمینه است. نتیجه روشهای PGT بسیار وابسته به بررسی مناسب بیماران توسط گروه درمان است. چنانچه دقت کافی در بررسی زوج نابارور بهعمل نیامده باشد، PGT بهعنوان آخرین مرحله نمیتواند نتیجه دلخواه را به همراه داشته باشد.
روشهای آزمایش پیش از لانهگزینی جنین برای بررسی آنیوپلوئیدی جنینها شامل دو نسل از انواع نمونهبرداری و شیوه آزمایش ژنتیکی است. نسل اول شامل نمونهبرداری از اجسام قطبی و جنینهای روز سوم در مرحله تسهیم و روش ژنتیکی عمدتا FISH است و نسل دوم شامل نمونهبرداری از جنینها در مرحله بلاستوسیست و روشهای بررسی هر ۲۴ کروموزوم است. نتیجهگیری قطعی از کارآزماییهای بالینی که تابهحال در زمینه PGT صورت گرفته و عمومیت دادن به آن بسیار سخت است. با توجه به شرایط اقتصادی امروزه کشور، بیماران بر انتقال تعداد بیشتری جنین اصرار دارند تا شانس بارداری خود را بالا برده و مجبور به هزینه مجدد برای تشکیل جنین نباشند. با انجام تستهای پیش از لانهگزینی جنین برای اختلالات آنیوپلوئیدی ممکن است با انتقال تعداد کمتر جنین، همچنان شانس بیشتری برای بارداری داشت.
پیرامون نسل اول روش PGT-A کارآزماییهای بالینی اگرچه موید بالاتر بودن میزان آنیوپلوئیدی در جنینهای متعلق به بیماران با پیشآگهی بد بود، ولیکن با وجود انتقال جنینهای یوپلوئید نیز این گروه بجز انتقال تعداد کمترجنین، نتیجه چندان بهتری در مقایسه با گروه کنترل نگرفتند. به غیر از اینکه ممکن است در این دسته از بیماران مشکلات دیگری نیز وجود داشته باشد که منجر به کاهش موفقیت روشهای کمک باروری میشود، ولی مشکلات خود روش انجام PGT-A نیز میتواند تاثیرگذار بوده باشد. از جمله محدودیتهای مرتبط با نسل اول، نمونهبرداری فقط یک سلول (بلاستومر) از جنین است و لذا اطلاعاتی در مورد سایر سلولهای جنین وجود ندارد و ممکن است سلول بیوپسی شده از جنین با خود جنین همخوانی نداشته باشد. از طرف دیگر در روش FISH تعداد کمی از کروموزومها مورد بررسی قرار میگیرند که این نیز از معایب بزرگ نسل اول PGT-A شمرده میشود .امروزه استفاده از روشهای نمونهبرداری از تروفواکتودرم و روشی که بتوانیم در آن هر ۲۴ کروموزوم را مورد بررسی قرار دهیم، موردتوجه قرارگرفته است. در کارآزماییهای نسل دوم، عمدتا شاهد انجام بر روی بیماران با پیش آگهی خوب هستیم تا احیانا وضعیت وخیم بیمار موجب پوشاندن اثر مثبت روشهای PGT-A نشود.
مطالعات غیر انتخابی در زمینه PGT-A مطالعاتی هستند که در آنها بیماران انتخاب و از تمامی جنینهایی که قرار است انتقال پیدا کند، نمونهبرداری انجام میشود، اما انتقال جنین پیش از دریافت نتیجه آزمایش ژنتیکی انجام میشود. پس از مشخص شدن نتیجه بارداری، بیماران بر اساس انتقال جنین آنیوپلوئید و یا یوپلوئید تقسیم بندی میشوند تا مشخص گردد که در کدام گروه بارداری در جریان و تولد زنده بیشتری وجود دارد. تفاوت یک کارآزمایی بالینی با مطالعه غیرانتخابی این است که در یک کارآزمایی بالینی، نفع کلینیکی آزمایش و اینکه چه گروهی از بیماران از آن بهره خواهند برد، مشخص میشود. اما در یک مطالعه غیر انتخابی، اعتبار کلینیکی یک آزمایش و روش آزمایشگاهی مشخص میشود. برای نمونه در مورد PGT-A مشخص میشود شرایط آنیوپلوئیدی و یوپلوئیدی تا چه حد در بارداری دخیل است، ولیکن اینکه کدام گروه بیماران از آن بهره خواهند برد، مشخص نمیگردد. به همین دلیل گفته میشود، مطالعات غیر انتخابی، مقدم بر کارآزمایی بالینی باید انجام شوند. قصد به درمان معیاری برای تفسیر نتایج RCT است تا بتوان درمان مناسبی برای گروهی از بیماران که بخوبی تعریف شدهاند، یافت. بر اساس این معیار پس از اینکه بیماران بصورت تصادفی در میان گروهها تقسیم شدند، نمیتوان آنها را به نحوی از انحاء حذف نمود. بهعنوان نمونه در روشهای کمک باروری بر این اساس نمیتوان بیمارانی را که فاقد جنین قابل انتقال بودند را از مطالعه خارج نمود و میزان موفقیت در بارداری و غیره را صرفا بر اساس تعداد بیماران با دریافت جنین محاسبه کرد.
در مورد روش PGT-A بر اساس بیوپسی تروفواکتودرم و بررسی جامع ژنومیک (24کروموزوم) به سبب اندک بودن تعداد تحقیقات انجام شده، یافتهها غیرمطمئن عنوانشده است. در این میان موضعگیری انجمنهای علمی بین المللی نیز مهم است. PGDIS که جامعه بین المللی PGD است، بیان میکند که مرور مطالعات نشان داده که PGT-A در بهبود بارداریهای در جریان، به ازای بیماران، با انتقال جنین و در مراکز با تجربه و زنان ۳۵ سال و بیشتر مفید است. آنها با توصیه بهبود در روشها، PGT- A را بعنوان بخشی از کنترل کیفی در بخشهای IVF پیشنهاد میکنند. ASRM انجمن آمریکایی تولید مثل در سال ۲۰۱۸ در مقالهای نظر کمیته خود را در زمینه PGT-A عنوان میکند. این کمیته بر این عقیده است که انتقال جنینهای یوپلوئید، موفقیت روشهای ART را تضمین نمیکند چرا که عوامل دیگری نیز در این موضوع دخیل هستند. از سوی دیگر آنها به این اشاره میکنند که اغلب مقالات منتشر شده تا سال ۲۰۱۹ با روشهای نسل دوم موید بهبودی خروجی و موفقیت روشهای ART هستند. درکل ASRM روشهای PGT-A را برای استفاده روتین توصیه نمینماید.
ESHRE یا جامعه اروپایی تولیدمثل و جنینشناسی در سال ۲۰۲۰ ، چهار دستورالعمل در خصوص PGT منتشر نموده است که بهویژه دو مورد آن در ارتباط با PGT-A قرار میگیرد. اگرچه این انجمن قصد از این مقالات را اظهار نظر در مورد سودمندی روش PGT-A نمیداند، ولیکن اشاره مختصری به آن مینماید. بهعنوان نمونه به موارد کاربرد PGT-A مانند سن بالای مادر، شکست مکرر در لانهگزینی جنین، ناباروری با علت مردانه شدید و سقط مکرر اشاره مینماید. تنها در مورد سقط مکرر بدون علت ژنتیکی در بیمار توصیه نمینماید و در کل تعریف موارد و بکارگیری این روشها را به مراکز ارائۀ خدمات وامیگذارد. به نظر میرسد، علیرغم سه دهه کاربرد نسلهای مختلف PGT-A همچنان در مورد اثربخشی آن شک و تردید جدی وجود دارد. رفع نواقصی همچون محدودیت روش FISH در بررسی تعداد کروموزومها و جایگزینی روشهای با امکان بررسی هر ۲۴ کروموزوم و یا رفع محدودیت تعداد سلول مورد بررسی با بیوپسی از سلولهای تروفواکتودرم درعوض تک بلاستومر، نه تنها نتوانسته است تردیدها را برطرف نماید، بلکه معضل موزاییسم جنین را نیز آشکار ساخته است. اخیرا انتقال جنینهای موزاییک با ارائه مقیاسهای نه چندان با پشتوانه علمی دقیق ترغیب شده است، اگرچه میزان لانهگزینی با ثبات و تولد زنده در مقایسه با انتقال جنین یوپلوئید کمتر گزارش شده است. در گایدلاینهای انتقال جنین موزاییک، موازیسم تا ۲۰ درصد، نرمال ۲۰ تا ۸۰ درصد بهعنوان موزائیک ولی بر حسب کروموزومهای درگیر قابل انتقال و بیش از ۸۰ درصد، آبنرمال و غیر قابل انتقال قلمداد شده است. در انتها باید تاکید نمود که PGT-A را باید بهعنوان آخرین اقدام پس از بررسیهای دقیق بیماران تجویز نمود. باید هر مرکز نتایج اقدامات خود در خصوص بیمارانی که خدمات PGT-A به آنها عرضه شده را به دقت رصد نماید و کارآیی آنرا برای دستههای مختلف بیماران سنجش نماید. توجه به کارآزماییهای سایر مراکز اگرچه مفید است ولیکن نمیتوان فقط با اتکای به آنها به ارائه خدمت به بیماران مرکز ادامه داد. هر مرکز باید تعاریف خود از مواردی همچون شکست مکرر لانه گزینی، سقط مکرر، سن بالای مادر و نظایر آن را داشته باشد و به چگونگی عرضه خدماتی نظیر PGT-A به آنان تصمیم بگیرد.
▪ تشخیص ژنتیکی پیش از لانه گزینی برای بیماریهای تک ژنی (PGT-M)
تشخیص ژنتیکی پیش از لانهگزینی برای بیماریهای تک ژنی یا PGT-M، گونۀ زودرس یا تسریع شده تشخیص پیش از تولد (prenatal diagnosis) است که در واقع همان آزمایشها که روی محصول بارداری انجام میشود، پیش از لانهگزینی و برای تشخیص مشکلات ژنتیکی که احتمالا از والدین به جنین منتقل شده بر روی نمونه بیوپسی جنین انجام میگیرد. البته در PGT-M هدف با PND متفاوت است. در PGD یا PGT هدف جلوگیری از آغاز یک بارداری حامل فرزند مبتلا است و در نتیجه با انجام PGT ما سعی میکنیم که احتمال یا اجبار به انجام ختم بارداری به دلایل پزشکی را تا حد امکان کاهش دهیم. به همین جهت در زوجهایی که دارای ریسک انتقال یک بیماری ژنتیکی به فرزندانشان هستند (چه مبتلا و چه حامل یک نقص ژنتیکی) این کار با هدف جلوگیری از تشکیل جنینی که فاقد اختلالات ژنتیکی شامل بیماریهای تک ژنی یا اختلالات کروموزومی باشد، انجام میگیرد. حدود ۴۰ هزار ژن عملکردی شناخته شده در بدن انسان وجود دارد که از این تعداد حدود ۱۰ هزار بیماری مرتبط با این ژنها شناخته شده است. بنابراین بیماریهای تک ژنی (Monogenic) بسیار متنوع هستند و الگوی توارثی آنها عمدتاً تابع توارث مندلی است که به اشکال اتوزومال غالب، اتوزومال مغلوب و وابسته به جنس انتقال پیدا میکنند. انواع بیماریهای مختلف در این بستر توارث سه گانه میتوانند قرار بگیرند. در الگوی اتوزومال مغلوب که اغلب پدر و مادر هر دو حامل هستند شانس ابتلای ۲۵ درصدی در فرزندان خواهیم داشت ، در حالی که در طرح توارث اتوزومال غالب ۵۰ درصد شانس ابتلا و در الگوی وابسته به جنس بسته به این که مغلوب یا غالب باشند متفاوت خواهد بود که در موارد وابسته به جنس مغلوب مانند بیماری دوشن، ما ۵۰ درصد ابتلای فرزندان مذکر و ۵۰ درصد شانس ناقل بودن فرزندان دختر را خواهیم داشت. بیماریهای تک ژنی زحمت و هزینههای بسیاری بر بخش بهداشت و درمان وارد میکنند. برای نمونه شاید شایعترین و مهمترین بیماری تک ژنی، تالاسمی است که در مناطقی از ایران نیز به صورت اندمیک وجود دارد. میزان هزینههایی که بیماران تالاسمی بر جامعه و سیستم بهداشت و درمان کشور وارد میکنند بسیار بالاست و تخمین زده شده در طی ۱۵ سال برای یک فرد مبتلا به تالاسمی ماژور حدود ۱۰۰ هزار دلار هزینه میشود. ضمن آنکه به دلیل شیوع به نسبت بالای موارد ناقلی (در جمعیت ایران میزانی حدود دو میلیون ناقل تخمین زده میشود) بهاضافه نرخ بالای ازدواجهای فامیلی (حدود ۳۸ درصد)، احتمال تولد فرزندان تالاسمی در زوجهای ناقل و خانوادههایی که حامل این نقصها هستند افزایش و بطور مستقیم میزان هزینهای که بر جامعه و سیستم بهداشتی و درمانی وارد میشود را نیز سنگین خواهد کرد. تا پیش از کاربرد PGT آنچه بهطور روتین در مورد تالاسمی و خانوادههایی که ناقل این وضعیت بودند در ایران انجام میشد بر مبنای استراتژی غربالگری پیش از ازدواج بود که بر اساس ایندکسهای گلبولهای قرمز صورت میگیرد و سپس نیز در مواردی که ازدواج میان ناقلان صورت گرفته از روش تشخیص پیش از تولد یا PND استفاده میشد که یک استراتژی تهاجمی است و عوارض خود را دارد. در این روش اگر زوج ناقل تالاسمی یا هر بیماری تک ژنی دیگری، حامل بارداری با جنین مبتلا تشخیص داده میشدند اقدام نهایی ختم بارداری بر اساس مجوز اخذ شده از پزشکی قانونی بود. بدیهی است سقط جنین با اندیکاسیون درمانی عوارض متعدد و تبعات مختلفی را نیز بر مادر و همچنین بر خانواده اعمال خواهد کرد. در مادرانی که به دلیل ابتلای جنین به بیماری، مجبور به سقط میشوند درصد بالایی از افکار خودکشی، اقدام به خودکشی، وابستگی به مواد مخدر و نیز اختلالات خلقی گزارششده است. با توجه به موارد گفته شده، استراتژی پیشنهادی از حدود سال ۱۹۹۰ در خانوادههایی که یک نوع نقص تک ژنی را حمل کرده و یا مبتلا به آن هستند، به ویژه در مواردی که زوجین از ناباروری نیز رنج میبرند استفاده از تشخیص پیش از لانه گزینی به عنوان گزینهای انتخابی در کنار تشخیص پیش از تولد است.
▪ مراحل کار در PGT-M :
در ابتدا زوجینی که نقص ژنتیکی در آنها شناخته شده به آزمایشگاه PGT مراجعه میکنند و تحت مشاوره اولیه (Pre-PGT) قرار میگیرند. در طی این جلسه وضعیت جهشها و واریانتهای پاتوژنیک آنها بررسی میشود و در خصوص روش PGT، مراحل عملیاتی و محدودیتهای آن توضیحات لازم به زوجین ارایه میگردد. همچنین نمونههای مورد نیاز از زوجین، والدین یا سایر افراد خانواده و یا در صورت وجود، نمونه فرزند یا جنین سقط شده مبتلا اخذ میگردد. در مرحله دوم Set up اولیه PGT برای خانواده مورد نظر انجام میشود. این مرحله برحسب فنآوری و روشی که در آزمایشگاه مورد نظر وجود دارد میتواند بسیار متفاوت باشد. سپس زوجین در چرخۀ IVF وارد میشوند و تشکیل جنین برای آنها صورت میگیرد. بسته به نوع استراتژی در نظر گرفته شده برای زوجین و بر حسب پروتکلهای کاری در آزمایشگاه جنین شناسی، نمونه برداری از جنین (بیوپسی) در روز سوم یا پنجم انجام میشود. سپس نمونه جنین به آزمایشگاه PGT ارسال میشود و آنجا آزمایشهای مرحله نهایی PGT که تعیین وضعیت ژنوتیپی جنین و درواقع پیشبینی فنوتیپ احتمالی فرزندان آتی خواهد بود، انجام میگیرد. در نهایت نیز گزارشی تهیه میشود که در آن جنینهایی که به لحاظ ژنتیکی قابل انتقال هستند ذکر میشود. در پایان دوباره در بخش جنینشناسی تصمیم نهایی برای شیوۀ انتقال جنینها گرفته میشود. پس از انتقال جنین خانواده در انتظار نتایج مثبت یعنی کاشته شدن موفق جنین و در واقع یک بارداری موفق که به تولد نوزاد زنده و سالم ختم شود، خواهند بود.
▪ تغییرات در روشهای PGT-M در طول زمان:
به لحاظ روشهای بیوپسی آنچه در بیشتر آزمایشگاهها برای تشخیص ژنتیکی بیماریهای تک ژنی پیش از لانهگزینی آغاز شد، نمونهبرداری از بلاستومر در روز سوم تشکیل جنین بود که همچنان نیز در برخی مراکز انجام میشود. در چند سال اخیر میل به استفاده از نمونهبرداری از سلولهای تروفواکتودرم در بلاستوسیست جنین پنجروزه افزایش یافته است که در این روش تعداد بیشتری سلول و در نتیجه ماده اولیه بیشتری در اختیار آزمایشگاه قرار داده میشود. به نظر میرسد که در آینده نمونهبرداری از جنین به سمت روشهای غیرتهاجمی بدون نمونهبرداری از سلولهای جنین و دستکاریهای کمتر خواهد رفت.
به لحاظ روشهای تشخیص مولکولی، تکثیر هدفمند که بر روی تکسلول آغاز شد همچنان نیز بهعنوان یک روش مولکولی در بسیاری از آزمایشگاهها استفاده میشود. در سالهای اخیر بهتدریج PCR برای تشخیص جهش منفرد جای خود را به duplex و در نهایت multiplex PCR که همزمان با جهش، تعدادی STR markerهای نواحی جانبی هست و جهش را در برگرفته را نیز تکثیر میکند، مورد استفاده قرار گرفت. با پیدایش روشهای high throughput مانندSNP array یا NGS استفاده از تکثیر کل ژنوم (WGA) مرسوم شد. در آینده در بسیاری از آزمایشگاهها WGA بهجای استفاده از محتوای سلولهای جنینی از محتوای DNA آزاد مایع بلاستوسل یا محیط کشت جنین استفاده خواهد کرد. در بیوپسی تروفواکتودرم ما میزان DNA بیشتری را نسبت به تک بلاستومر در اختیار داریم و به همین دلیل میتواند نقایص مهم تشخیصی که در بیوپسی بلاستومر با آن به میزان زیاد روبرو هستیم، همچون amplification failure, Allele Drop Out (ADO) یا بحث آلودگی با DNA خارجی کاهش داده و در نتیجه قدرت تشخیصی ما با بیوپسی تروفواکتودرم افزایش پیدا میکند. سه روش اصلی تکنیکال در حال حاضر در PGT-M مطرح است. تکنیک اول شامل targeted amplification است که در این روش موتاسیون یا واریانت بیماریزایی را که در خانواده شناخته شده را بهطور مستقیم تشخیص میدهیم و در کنار آن از linkage analysis استفاده میکنیم. این تکنیک بهعنوان یک روش روتین در آزمایشگاه PGT است و روشی است که قدرت تشخیصی خوبی برای ما ایجاد میکند. همچنین این تکنیک در مواردی یک جهش جدید (Novel) که پیش از این در خانواده گزارش نشده را بررسی میکنیم نیز، قابلاستفاده است. این متد تقریباً در تمام موارد بیماریهای تک ژنی که یک واریانت شناخته شده و پاتوژنیک در خانواده وجود دارد قابل انجام است و مهمتر از همه بهویژه در جامعه ما، این روش میزان هزینه قابل قبولی را برای بیماران در بر خواهد داشت. البته معایبی نیز دارد که مهمترین آن، Setup اولیه طولانی آن است که زمان و کار زیادی میبرد. در حال حاضر در آزمایشگاه ممکن است بعضا ۳ الی ۴ ماه این مرحله به طول انجامد، ضمن اینکه پروبهایی که برای نشانگرها استفاده میشود ممکن است به تعیین مارکرهای واجد اطلاعات مفیدختم نشود و لازم باشد که ما تعداد بیشتری مارکر طراحی و استفاده نماییم که زمان را طولانی تر خواهد کرد.روش دوم که از سال ۲۰۱۳ به بعد در برخی از آزمایشگاههای PGT وارد شد karyomapping است که در واقع بر اساس SNP array انجام میشود و درنهایت یک تشخیص غیرمستقیم از کروموزوم حامل جهش به دست میدهد. از مزیتهای این روش مرحله setup کوتاه و راحت آن است و اینکه برای تمامی موارد بیماریهای تک ژنی که ژن و جهش آن شناخته شده باشد، قابلاستفاده است. از معایب آن این است که در نقاطی از ژنوم که SNPهای informative تراکم اندکی دارند، مانند نواحی تلومری قابلاستفاده نیست. همچنین انجام آن حتماً نیاز به حضور و بررسی یک فرد مبتلا در خانواده زوجین کاندید PGT دارد. درنهایت این که برای تشخیص جهشهای جدید (Novel) نمیتواند مورداستفاده قرار گیرد و مواد و کیتهای این روش بسیار گرانقیمت است. روش سوم NGS است که بهصورت مستقیم جهش یا واریانت پاتولوژیک را در خانواده و در جنین بررسی میکنیم و همزمان میتوانیم چندین ژن مختلف، چندین جهش و چندین عامل بیماریزا را بررسی کنیم. مشکل عمده گران بودن کیتها و مواد مورد استفاده و نیز تجهیزات مورد نیاز است. کاربرد روش سوم یعنی NGS که در بحث آنیوپلوئیدی به آن پرداخته شده است، میتواند در جنین مادرانی که سن بالا دارند یک روش ارجح باشد چرا که نرخ بروز آنیوپلوئیدی در جنین این مادران افزایشیافته است. در روش NGS که برای بیماران تک ژنی و کاندید PGT استفاده میشود، بیشتر از targeted NGS استفاده میشود، ضمن آن که برای تشخیص جهشهای نقطهای باید عمق خوانش بالایی را در NGS داشته باشیم.
بهطور اختصار استاندارد طلایی همان روش targeted PCR است که بهصورت مستقیم جهش و در کنار آن STR markerهایی که به جهش پیوسته هستند را مورد بررسی قرار میدهد. از خصوصیات این مارکرها میتوان به پلی مورفیک بودن آنها اشاره کرد، یعنی بایستی هتروزیگوسیتی بالایی در جمعیت داشته باشند و وضعیتهای مختلفشان بتوانند افتراق بین افراد را برای ما امکانپذیر سازد. این مارکرها باید informative باشند یعنی بتوانند میان زوجین نیز افتراق ایجاد کنند و وضعیتها یا سایزهای آللیک متفاوتی داشته باشند تا ما بتوانیم از آنها برای تفکیک وضعیت جهش در جنین استفاده کنیم. این مارکرها باید تا حد امکان به واریانت پاتولوژیک مورد نظر نزدیک باشند. در واقع هرچقدر مارکر نزدیکتر باشد ارزش تشخیصی بالاتری دارد و هرچقدر که پلی مورفیکتر باشد، بیشتر informative خواهد بود. در خصوص مسیر آینده روش PGT بنظر میرسد بهزودی بررسی بیماریهای چندژنی و چندعاملی که از وراثت مندلی تبعیت نمیکنند، بهزودی در دستور کار قرار گیرند. گرچه عوامل اپیژنتیک و عوامل محیطی نیز بر روی این بیماریها تأثیرگذار هستند و در یک نگاه واقعی شاید همانند بیماریهای مندلی به طورقطع قابلتشخیص نباشند. اما بههرحال بر اساس اثرات متقابل و جمعی مجموعههای ژنی مرتبط با آن بیماری چندعاملی در حال حاضر میتوانیم با دقت خوبی تعیین ریسک خطر یا بروز را انجام دهیم . بر این اساس بررسی ریسک احتمال ابتلا به بیماریهای چندعاملی یا چندژنی مثل سرطان و دیابت در جنین بر اساس نتایج بررسیهای کلی ژنومیک میتوانند مطرح باشند. این بدان معنا خواهد بود که در آینده در بررسی جنینی که به لحاظ آنیوپلوئیدی بهروش NGS مطالعه میشود، ما میتوانیم احتمال ابتلای بیماریهای زمینهای که در خانواده بهصورت چندعاملی وجود داشته است ، مانند بیماری کرونری قلب، سرطان و یا دیابت را به روش PGT بررسی کنیم و به نظر میرسد بهزودی PGT به سمت انتخاب جنینهایی با ریسک کمتر به لحاظ بروز بیماریهای چندعاملی برود.
در نهایت در بررسیهای ژنتیکی جنین پیش از لانهگزینی موضوع مربوط به اخلاق پزشکی نیز دارای اهمیت بوده و به دفعات این پرسش مطرح میشود که ممکن است اقدامات و روشهای PGT و غربالگری جنین در آینده به سمت انتخاب جنینهایی با صفات برتر برود. در مجموع علیرغم ارائه و تکمیل روشهایی مانند ژندرمانی و ویرایش ژنی، در حال حاضر بهترین، راحتترین و امنترین روش برای پیشگیری از تشکیل و تولد یک جنین مبتلا در خانوادهای که دارای یک اختلال ژنتیکی میباشد، همچنان استفاده از روش تشخیص پیش از لانه گزینی جنین میباشد.بر همین اساس در پژوهشگاه رویان نیز، از اوایل دهه ۸۰ ارایه خدمات PGT به زوجین آغاز شد و اولین نوزادان حاصل از PGT در ایران در مرکز درمان ناباروری رویان بهدنیا آمدند. در حال حاضر PGT با روشهای FISH و array CGH برای اختلالات ساختاری کروموزومی و آنیوپلوئیدی در حال انجام است و برای بیماریهای تک ژنی در زوجینی که ژن عامل بیماری و واریانت بیماریزای آنها شناخته شده باشد بطور روتین روش PGT-M ارائه میگردد. در طی سالیان گذشته برای بیش از ۱۰۳ بیماری تک ژنی و ژن بیماریزای مختلف، خدمات PGT-M شامل setup اولیه و نیز ارایه خدمات فاز نهایی انجام گرفته است. این بیماریها طیف وسیعی داشته و شامل تالاسمی (آلفا، بتا)، فیبروز کیستیک، ناشنواییارثی، کلیه پلیکیستیک، آتروفیعضلانینخاعی (SMA)، هموفیلی، سندروم ایکس شکننده، بیماری بال پروانهای (اپیدرمولیز بولوزا)، بیماریهای متابولیک و نیز مواردی از استعداد به سرطانهای ارثی (Cancer susceptibility) میباشند. نتایج انجام PGT-M بر روی ۵۱۳ زوج کاندید در طی ۶ سال گذشته که در طی۳۶۰ سیکل ART بر روی ۲۳۳۳ جنین صورت گرفته منجر به حدود ۳۷.۷ درصد سیکل انتقال جنین و بارداری موفق در بیش از ۲۷ درصد زوجین گردیده است.
دکتر مسعود بذرگر، دکتر محمدرضا زمانیان، دکتر حمید گورابی
پژوهشکده زیست شناسی و علوم پزشکی تولید مثل جهاد دانشگاهی، مرکز تحقیقات پزشکی تولید مثل، گروه ژنتیک ناباروری، پژوهشگاه رویان، تهران، ایران



ثبت نظر