پژوهشهای جدید دانشکدهی پزشکی دانشگاه واشنگتن در سنتلوئیس نشان میدهد دارویی که در درمان نارسایی قلبی استفاده میشود، میتواند برای درمان اسکلروز جانبی آمیوتروفیک (ALS) (که بهعنوان بیماری لوگرینگ نیز شناخته شدهاست) نیز استفاده شود.
بهتازگی اسکلروز جانبی آمیوتروفیک (ALS) بهدلیل چالش معروف «سطل یخ» Ice Bucket Challenge در کانون توجه بوده است اما دراین بیماری بهطور جدی، سلولهای عصبی که کنترل عضلات را دردست دارند تخریب میشوند؛ که منجر به ازدستدادن تحرک، تنفس و مشکلات بلع و مرگ میگردد.
به گزارش انجمن ALS هرساله حدود 5600 نفر در ایالاتمتحده با ALS تشخیص داده میشوند. میزان بروز بیماری 2 در 100،000 نفر است و در هر زمان ممکناست بیشاز30،000 آمریکایی مبتلا به ALS باشند.
انجمن ALS، امید به زندگی بیمار ALS را بهطور متوسط 2تا5سال از زمان تشخیص میداند، هرچند بسیاری از بیماران 5سال یا بیشتر زندگی با کیفیتی دارند.
تنها داروی موردتأیید FDA برای درمان این بیماری، بهنام ریلوزولriluzole، تنها «منافع جزیی» در بیماران نشان داد.
محققان مسئول مطالعه جدید، چگونگی اینکه وقتی آنها فعالیت آنزیم را کاهش دادند یا توانایی سلولها را در ساخت نسخههای بیشتر از آنزیم محدودکردند، تخریب سلولهای عصبی توسط ALS متوقف شد را در مجلهی Nature Neuroscience بهچاپ رساندند.
توضیح آنها این بود که آنزیم تعادل سدیم و پتاسیم را در سلولها حفظ مینماید اما آنها آنزیم را با دیگوکسین (داروی مورد استفاده در درمان نارسایی احتقانی قلب و آهسته نمودن ضربان قلب در بیماران مبتلا به فیبریلاسیون دهلیزی) مهارکردند.
نویسندهی ارشد دکتر آزاد بونی اینگونه توضیح میدهد که: «این دارو در جلوگیری از مرگ سلولهای عصبی که بهطور معمول در مدل کشت سلولیALS کشته میشوند اثر بسیا قوی داشت».
آستروسیتها نقش کلیدی در اختلالات تخریب عصبی دارند:
دکتر بونی و همکارانش برای انجام تحقیقات خود پاسخ استرس سلولی مغز را در مدل موشی ALS بررسی کردند. موش دارای نسخهی جهش یافته از ژن بود که باعث شکل ارثی بیماری ALS میشد و براساس توضیح تیم، بسیاری از علائم دیده شده در انسان مبتلا به ALS در موش نیز وجود داشت.
هنگامی که آنها فعالیت پروتئین پاسخ به استرس را در موش بررسی میکردند، بهطور غیرمنتظرهای با آنزیم دیگری (بهنام سدیم ـ پتاسیم ATPase) مواجه شدند که سدیم را از سلول بیرونرانده و پتاسیم باردار را وارد سلول میکند؛ عملکرد این آنزیم موجب حفظ بارالکتریکی درسراسر غشای بیرونی سلول میشود.
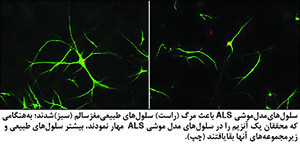
محققان اینطور توضیح میدهند که حفظ این بارالکتریکی برای عملکرد عادی سلولها حیاتی است. سدیم ـ پتاسیم ATPase خاص یافتشده دراین تحقیقات متعلق به سلولهای سیستم عصبی بهنام «آستروسیتها» بودند. اما در موش با ALS، میزان آنزیم بالاتر از آنچه که در آستروسیتهای طبیعی یافت میشود، بود.
نتایج بررسی آنها نشانداد که افزایش آنزیم سدیم ـ پتاسیم ATPase باعث تسریع انتشار سایتوکاینهای التهابی توسط آستروسیتها میشود که ممکناست نورونهای حرکتی را از بین ببرند.
در بررسیهای قبلی پیشنهاد شدهاست که آستروسیتها نقش کلیدی در اختلالات تخریب عصبی دارند؛ ازجمله ALS، آلزایمر، هانتینگتون و بیماری پارکینسون.
دکتر بونی توضیح میدهد که قرار دادن آستروسیتهای موش با ALS در ظروف کشت درکنار نورونهای حرکتی سالم باعث انحطاط و مرگ آنها (سلولهای سالم) میشود؛
وی اضافه میکند که: «اگرچه سلولهای عصبی طبیعی هستند، چیزی در آستروسیتها وجود دارد که به سلولهای عصبی سالم آسیب میرساند.»
اگر آنزیـم با دیگوکسین مهار شـود، سلولهای عصبی حرکتی بقا مییابند:
اما مکانیزم آسیب نورونها توسط آستروسیتها نامشخص است. بااینحال یافتههای تیم تحقیقاتی نشان میدهد که آنزیم سدیم ـ پتاسیم ATPase یک جزء حیاتی این مکانیسم تخریب است.
با مهار آنزیم در آستروسیتهای ALS با استفاده از دیگوکسین، محققان دریافتند که سلولهای عصبی حرکتی بقا مییابند. توضیح آنها این بود که دیگوکسین توانایی سدیم ـ پتاسیم ATPase را در خارجکردن سدیم و واردنمودن پتاسیم مهار میکند.
از میان موشهای دارای نسخه جهش یافته ژن و در واقع موشهای مبتلا به ALS ارثی، موشهایی که تنها یک کپی از ژن سدیم ـ پتاسیم ATPase را داشتند، درمقایسه با موشهای با دو نسخه از ژن در حدود 20روز بیشتر بقا داشتند.
دکتر بونی میگوید:«موش دارای یک کپی از ژن سدیم ـ پتاسیم ATPase زندگی طولانیتر و پرتحرکتری دارد»؛ «آنها نرمال نیستند اما میتوانند راه بروند و در نخاع خود سلولهای عصبی حرکتی بیشتری دارند».
باتوجه به گفتههای تیم، زمانی که سلول یک کپی از ژن دارد آنزیم کمتری میسازد.
اگرچه این یافتهها نقطهی شروعی برای بررسیهای بیشتر هستند، دکتر بونی اشاره میکند که هنوز پرسشهای مهم درمورد اینکه چگونه مهارکنندههای آنزیم سدیم ـ پتاسیم ATPase میتوانند بهمنظور کاهش سرعت فلج پیش رونده درALS مورد استفاده قرارگیرند، باید پاسخ داده شوند.
به تازگی در «M.N.T» مطالعهای را که نوعی بیثباتی پروتئینی را علت احتمالیALS پیشنـهاد مینـمایـد، گـزارش شـده است.


ثبت نظر